Перейти к:
Получение адсорбентов для извлечения тяжелых металлов из сточных вод горнорудной промышленности
https://doi.org/10.17073/2500-0632-2024-02-224
Аннотация
Деятельность горно-металлургических предприятий неразрывно связана с потреблением больших количеств воды и соответственно образованием жидких отходов. Приоритетным является решение проблем переработки и рациональной утилизации технологических вод с высоким содержанием ценных компонентов. Это позволяет получать значимый эколого-экономический эффект, то есть приносить прибыль непосредственно предприятиям, экономить материальные ресурсы и снижать нагрузку на окружающую среду в горнопромышленных регионах. Переработка медно-цинковых руд сопровождается формированием металлоносных потоков с широким спектром сопутствующих металлов и неметаллов с низкой концентрацией каждого отдельного компонента и колебаниями рН в широких пределах. Указанные факторы затрудняют выбор рациональной технологии очистки, поэтому предприятиям приходится платить за сверхнормативные металлоносные сбросы в окружающую среду. Тяжелые металлы токсичны, не подвергаются разложению, могут аккумулироваться водными растениями и по пищевой цепи достигать организма человека. Централизованная аккумуляция случайных сбросов, поверхностных и дренажных вод с последующей очисткой для использования в оборотном водоснабжении может решить ряд экологических задач в области охраны водных ресурсов. Адсорбция тяжелых металлов цеолитами на основе недорогих глинистых минералов благодаря простоте процесса, возможности регенерации цеолитов, высокой эффективности ионообмена Cu2+, Zn2+ и Fe2+ с выделением в окружающую среду нетоксичных катионов Na+ является хорошей альтернативой химическому осаждению. Целью настоящей работы является оптимизация условий получения цеолитов на основе каолина и бентонита для очистки сточных вод, образующихся при добыче и переработке руды медно-колчеданно-полиметаллических месторождений. За основу синтеза цеолитов из необогащенной продукции горнодобывающей отрасли принята технология щелочного сплавления бентонита или каолина с гидроксидом натрия. Новизной технологического подхода при получении цеолитов из природных алюмосиликатов по сравнению с опубликованными данными является то, что корректировку химического состава щелочного сплава для синтеза цеолитов с определенной кристаллической структурой осуществляли с помощью отходов суспензии Al2O3–NaAlО2. Щелочной сплав растворяли в воде, фильтровали и подвергали гидротермальной кристаллизации. Изучен фазовый состав цеолитных адсорбентов. В результате сравнения эффективности извлечения тяжелых металлов из модельных растворов оптимизированы состав массы и условия процессов щелочного плавления, а также режим гидротермальной кристаллизации. Благодаря достигнутой степени извлечения металлов на уровне 95 % из модельных растворов с начальной концентрацией, мг/л: 150 Сu2+, 180 Zn2+ и 125 Fe2+, цеолиты на основе бентонита и каолина могут быть использованы при очистке металлоносных вод.
Ключевые слова
Для цитирования:
Мирзаева Е.И., Исаева Н.Ф., Ялгашев Э.Я., Турдиева Д.П., Боймонов Р.М. Получение адсорбентов для извлечения тяжелых металлов из сточных вод горнорудной промышленности. Горные науки и технологии. 2025;10(1):45-55. https://doi.org/10.17073/2500-0632-2024-02-224
For citation:
Mirzaeva E.N., Isaeva N.F., Yalgashev E.Ya., Turdiyeva D.P., Boymonov R.M. Preparation of adsorbents for the extraction of heavy metals from mining wastewater. Mining Science and Technology (Russia). 2025;10(1):45-55. https://doi.org/10.17073/2500-0632-2024-02-224
Получение адсорбентов для извлечения тяжелых металлов из сточных вод горнорудной промышленности
Введение
Развитие горнорудной промышленности сопровождается формированием специфических техногенных систем, включая рудничные, шахтные, карьерные и подотвальные воды, а также пылевое загрязнение при разработке месторождений [1]. Соединения меди, цинка, свинца, железа и других тяжелых металлов оказывают негативное воздействие на гидросферу, а также на здоровье населения, особенно детского возраста [2]. Предприятия при переработке руды применяют различные технологии для максимального извлечения цветных металлов из техногенных вод и возврата в производственный цикл [3]. Однако мониторинг природных вод в зоне влияния предприятий горно-обогатительных комбинатов и цветной металлургии свидетельствует о явном превышении санитарных норм в сточных водах [4]. Сброс неэффективно очищенной воды Алмалыкским горно-металлургическим комбинатом обусловил превышение допустимого содержания цинка, свинца, меди, железа, марганца и молибдена в створе водопользования реки Ахангаран [5]. Чтобы снизить влияние антропогенного фактора на гидросферу, целесообразно удалять вредные примеси в устройствах очистки на месте использования водных ресурсов промышленными предприятиями.
В практике очистки воды от умеренно концентрированных загрязнений все чаще используют природные цеолиты [6–8], главным достоинством которых является дешевизна. Несмотря на высокую селективность клиноптилолита по отношению к тяжелым металлам (Pb2+, Cd2+, Cu2+, Co2+, Cr3+, Zn2+, Ni2+, Hg+, Fe3+) адсорбционная емкость природных цеолитов в несколько раз меньше, чем синтетических [7, 9]. Поэтому возрастает интерес исследователей к синтезу цеолитов из глинистых минералов [10–12], пустой угольной породы [13–15], щебня [16] и других дешевых отходов [17, 18]. V. Somerset V. с соавторами выявили эффект снижения концентрации Ni, Zn, Cd и Hg после обработки кислых дренажных вод шахт цеолитами (фожазита) [19]. Преобразование исходных компонентов в цеолиты с каркасной структурой осуществляют исходя из фазового состава, химической активности и термостабильности минерального сырья, а также предполагаемой области применения. Дорогостоящие однофазные цеолиты типа NaA, NaX или NaY производят двухстадийной кристаллизацией из чистых реагентов при строгом соотношении Na2SiO3, NaОН и NaAlO2 [20, 21], так как однократная гидротермальная кристаллизация не позволяет получать цеолиты определенной структуры без примеси посторонних фаз. Гидротермальная обработка каолинов, прокаленных при 550–650 ºС (с незначительным содержанием кварца и других тугоплавких минералов) щелочным раствором, предпочтительна при синтезе цеолита NaA вследствие благоприятного соотношения Si/Al, близкого к двум. Термически более устойчивые бентониты [10], каолины в составе пустой угольной породы [13] прокаливают при температуре около 800 ºС, а на гидротермальной стадии прибегают к дополнительным источникам алюминия. Перспективным способом переработки низкосортной продукции горнодобывающих предприятий в адсорбенты для очистки сточных вод от тяжелых металлов является плавление кремний-алюминийсодержащего сырья вместе с NaOH и последующей гидротермальной кристаллизацией растворимых продуктов щелочного сплава в цеолиты [14, 15, 22].
Целью настоящей работы является синтез цеолитных адсорбентов, эффективных при очистке сточных вод горно-металлургической промышленности из низкосортного природного сырья. Задачи: 1) определение фазового и элементного состава, а также термостабильности глинистых минералов Узбекистана; 2) определение влияния условий щелочного сплавления бентонита и каолина на фазовый состав и структуру цеолитов – продуктов гидротермальной кристаллизации; 3) оценка эффективности синтезированных цеолитов при извлечении меди, цинка, железа и свинца из модельных водных растворов и подотвальных рудничных вод.
Материалы и методы исследования
В работе использованы нативные глинистые минералы – Навбахорский бентонит (NB), Ангренский рудопробный пестроцветный каолин (VK) и суспензия алюмината натрия (SAS). Суспензия алюмината натрия – это остаток, образующийся при переработке алюмооксидных отходов в адсорбенты галоидсодержащих соединений. Фазовый состав, %: NaAlO2 – 30–33, NaOH – 1,5–2,5; Na2CO3 – 0,3–0,5, вода – остальное. Цеолиты, полученные на основе бентонита и каолина, обозначены далее как NBS и VKS. Шифры готовых образцов, условия их синтеза и фазовый состав приведены в табл. 1. Применялись также коммерческие ингредиенты: 99 %-ный гидроксид натрия, соляная кислота (36,5 %-ная HCl) и 99 %-ный полиэтиленполиамин (PEPA). Бентонит имел элементный состав, % масс.: О – 51,03; Si – 26,95; Al – 7,25; Mg – 1,42; K – 1,65; Fe – 7,21; Na – 1,24; Са – 2,32; Ti – 0,32; S – 0,20 и Р – 0,35. Каолин содержал, % масс.: О – 53,38; Si – 25,49; Al – 10,59; Mg – 0,1; K – 0,81; Ва – 0,22; Fe – 1,91; Pb – 0,05; Na – 0,12; Са – 0,22. Суспензия алюмината натрия с плотностью 1,23 г/см3 после сушки при 350 ºС включала, % масс.: О – 41,57; Al – 30,37; Na – 25,82; С – 2,08; Cl – 0,14.
Преобразование глинистого сырья в растворимые алюминаты и алюмосиликаты натрия осуществляли щелочным сплавлением с NaОН [11], корректируя соотношение SiO2/Al2O3 и Na2O/SiO2 в смеси добавкой суспензии алюмината натрия. Молярное соотношение SiO2/Al2O3 варьировали в пределах 1,5–7,17, а Na2O/SiO2 от 0,016 до 1,5. Бентонит и каолин для синтеза 7-NBS и 6-VKS предварительно подвергали частичному выщелачиванию примесей Са, Mg, K и Fe путем термообработки в 2М растворе HCl с последующим промыванием и сушкой при 120 ºС. Смесь ингредиентов подвергали мокрому помолу в шаровой мельнице в течение часа, переносили в фарфоровые чашки, сушили при температуре 80–120 ºС, а затем прокаливали с выдержкой 3 ч при температуре 810 ºС. Продукты щелочного сплавления измельчали, переносили в колбу с мешалкой и добавляли дистиллированную воду в соотношении жидкость : твердый продукт (Ж : Т) от 2,9 :1 до 6,6 : 1.
После перемешивания в течение 30 мин жидкость отфильтровывали от твердого остатка в полипропиленовую колбу [21], добавляли затравочные кристаллы из расчета 0,2 г порошка свежих цеолитов NaA или NaX на 100 г реакционной массы. При синтезе 8-NBS и 5-VKS в прозрачный фильтрат добавляли по 60 г РЕРА, а реакционные смеси для образцов 9-11-NBS и 8-VKS перед помещением в автоклав подвергали воздействию микроволнового излучения в течение 0,5 ч (см. табл. 1). Каждый из полученных прозрачных растворов в полипропиленовой колбе помещали в автоклав и выдерживали при температуре 35 ºС в течение 15–25 ч для установления равновесия в реакционной смеси. Затем повышали температуру до 80 ºС и выдерживали в течение 4 ч. Оптимальную температуру индукционного периода и стадии роста кристаллов выбирали для каждого раствора щелочного сплава в зависимости от результатов фазового анализа проб, отбираемых через каждый час. Кристаллические продукты отделяли на нутч-фильтре, промывали водой до нейтрального значения рН жидкой фазы, сушили и прокаливали при температуре 300 ºС.
Для исследований в динамическом режиме порошки 8-NBS и 6-VKS формовали экструзией в гранулы диаметром 1,0 мм и длиной 1,0–1,3 мм. Формовочную смесь готовили смешением порошка цеолита с очищенным от примесей бентонитом и раствором карбоксиметилцеллюлозы. Высушенные и прокаленные при 300 ºС гранулы перед адсорбцией подвергали обработке раствором Na2CO3. Степень удаления тяжелых металлов в статических условиях определяли в порошковой форме. Конические колбы, содержащие по 100 мл исследуемого раствора и точную навеску соответствующего цеолита (0,05–1,0 г), устанавливали в шейкере при температуре 25 ºС. Время встряхивания варьировали от 10 до 600 мин. Динамические испытания проводили в колонке диаметром 1,25 см при высоте слоя частиц цеолита – 120 см и скорости истечения жидкости от 6 до 18 см3/мин. Степень удаления вредных примесей из воды оценивали фотоколориметрическим методом по изменению концентрации соответствующих металлов при контакте с образцом цеолита. Цинк определяли в виде комплексного соединения с дитизоном (аналитическая длина волны λ = 535 нм), а медь с диэтилдитиокарбаматом свинца (λ = 430 нм). Измеряли оптическую плотность растворов комплексных соединений: цинка с дитизоном (аналитическая длина волны λ = 535 нм), меди с диэтилдитиокарбаматом свинца (λ = 430 нм), а железа с сульфосалициловой кислотой (λ = 430 нм). Концентрацию свинца определяли хроматным методом при λ = 540 нм с использованием дифенилкарбазида.
Адсорбционную емкость определяли по формуле:
A = (Cнач – Cкон)V∙100/m,
где A – адсорбционная емкость; Cнач – начальная концентрация вещества, г/л; Cкон – концентрация исследуемого вещества в растворе при равновесии, г/л; m – масса адсорбента, г; V – объем модельного раствора, л [11]. Элементный состав исследуемых образцов определяли на сканирующем электронном микроскопе (СЭМ) EVOMA 10 (Zeiss). Дифрактограммы, полученные в результате рентгенофазового анализа (РФА), исходных веществ и синтезированных цеолитов получены на дифрактометре Еmpyrean с использованием CuKα излучения, а термограммы на дериватографе HESON HS-TGA-103 со скоростью нагрева 10 ºС/мин.
Результаты эксперимента
Из дифрактограмм, рис. 1, следовало, что взятое сырье представляло смесь различных минералов и существенно отличалось молярным соотношением SiO2/Al2O3 = 4,64 (каолин) и 7,17 (бентонит) – одной из важнейших характеристик для синтеза цеолитов.
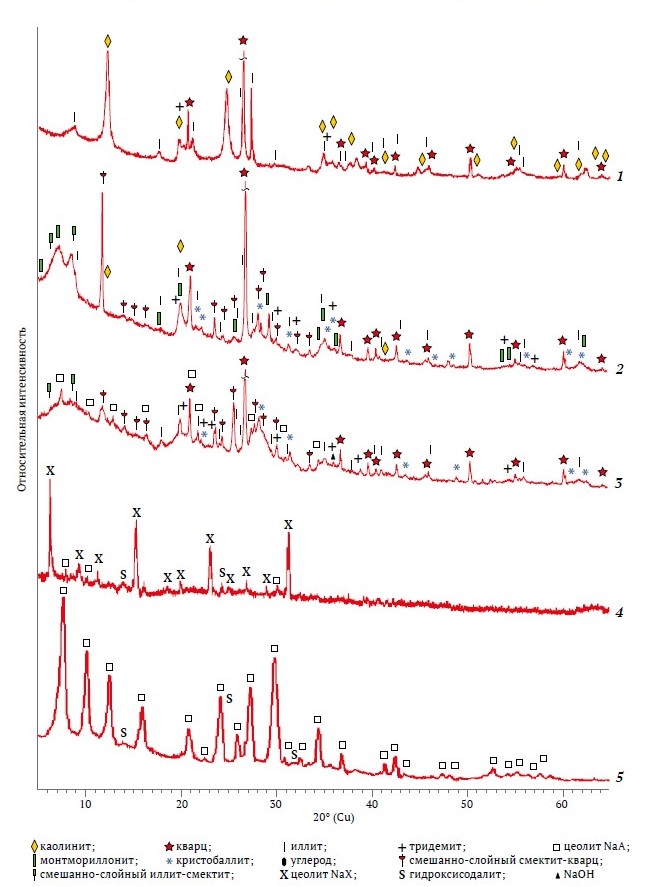
Рис. 1. Дифрактограммы: 1 – VK; 2 – NB; 3 – 4-NBS (щелочное сплавление при 800 °С – 5 ч); 4 – 8-NBS; 5 – 6-VKS
На дифрактограмме каолина к проявлению породообразующего минерала каолинита отнесены несколько уширенные рефлексы с d = 0,714; 0,446; 0,357; 0,2568; 0,2504; 0,2387; 0,2343; 0,221; 0,1989; 0,1790; 0,1666; 0,1490; 0,1375; 0,701; 0,129; 0,1236 нм. Каолинит – слоистый алюмосиликат с химической формулой Al2Si2O5(ОН)4 [6], где молярное соотношение SiO2/Al2O3 было равно двум, как в цеолите NaА. Относительная интенсивность базальных рефлексов каолинита была меньше, чем кварца, к тому же наблюдались рефлексы, отнесенные к иллиту – гидрослюдистому калийсодержащему минералу (K<1Al2[Al,Si)4O10].(OH)2.n H2O (d = 0,998; 0,498; 0,421; 0,333; 0,320; 0,298; 0,256; 0,243; 0,239; 0,224; 0,218; 0,212; 0,198; 0,166, 0,164; 0,150 нм). Процесс дегидроксилирования каолинита в аморфный метакаолин протекал в диапазоне 490–610 ºС, а иллит и кварц не претерпевали фазовых превращений до 800 ºС (рис. 2, термограмма 1).
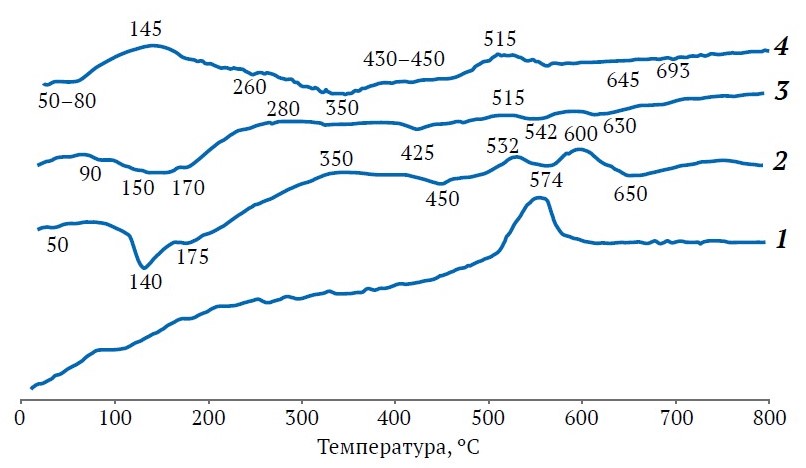
Рис. 2. Термограммы компонентов, использованных при синтезе цеолитных адсорбентов: 1 – пестроцветный каолин (VK); 2 – Навбахорский бентонит (NB); 3 – щелочной сплав для образца 4-NBS; 4 – щелочной сплав для образца 2-VKS
Породообразующим минералом бентонита являлся монтмориллонит из группы смектитов, идентифицированный по основным рефлексам с d = 0,568; 0,704; 0,809; 0,4472; 0,3422; 0, 3053; 0,2598; 0,1711; 0,1672 и 0,1504 нм наряду с рефлексами от кварца, смешанно-слойных фаз: смектит-кварц и смектит-иллит (см. рис. 1, дифрактограмма 2). Указанные рефлексы частично совпадали с рефлексами от иллита, каолинита и α-кристобалита, что характерно для месторождений тонкодисперсных глин [10]. После прокаливания бентонита при 600–650 ºС каолинит и монтмориллонит рентгенографически уже не проявлялись, зато увеличивался фон в области углов 2θ = 18–32º от аморфных продуктов их дегидроксилирования, сохранялись рефлексы от иллита, но преобладали рефлексы от кристаллических полиморфов SiO2. Идентифицированные в бентоните и каолине фазы тридимита, α-кристобалита и слюдистых минералов сохранялись после термообработки при 850 ºС, поэтому требовали термохимической активации щелочными реагентами [11]. В сплавах бентонита или каолина с NaOH при 800ºС интенсивность линий кварца составляла 50 % от исходной, но резко уменьшалась при повышении температуры сплавления до 810 ºС. Термограмма нативного бентонита в совокупности с данными рентгенофазового анализа после его прокаливания при 550 ºС подтвердила, что изменение формы и некоторое смещение рефлексов от монтмориллонита обусловлено трансформацией большей части набухающей фазы монтмориллонита в иллит, не склонный к набуханию. Молекулярная вода удалялась при 50, 140 и 175 ºС с уменьшением массы на 9,2 %, а дегидроксилирование структурных ОН-групп с потерей массы 1,8 % происходило при 450, 574 и 650 ºС (см. рис. 2, термограмма 2).
Суспензия алюмината натрия после удаления воды представляла смесь рентгеноаморфных алюминатов натрия в пересчете на NaAlO2 и кристаллических фаз, %: гиббсита – 28,7; NaОН – 10,9; Na2СO3 – 1,98 и NaCl – 0,024. После прокаливания при 810 ºС взамен гало от аморфных фаз на дифрактограмме появлялись широкие рефлексы от γ-NaAlO2 (d = 0,425; 0,294; 0,259; 0, 215; 0,1994; 0,1970; 0,1881; 0,1747 нм) и NaAl11O17 (d = 1,128; 0,569; 0,280; 0,2518; 0,2424; 0,2380 нм). О превращении гиббсита в γ-Al2O3 свидетельствовали рефлексы с d = 0,198 и 0,139 нм. Кристаллическому Na2СO3 соответствовали малоинтенсивные узкие рефлексы с d = 0,2963; 0,26; 0,254; 0,236; 0,218 нм. Шифры цеолитов, полученных при оптимальных условиях, количество ингредиентов в смесях для щелочного сплавления и гидротермальной обработки продуктов их выщелачивания, а также результаты рентгенофазового анализа синтезированных цеолитов представлены в табл. 1.
Таблица 1
Влияние параметров синтеза щелочным плавлением 100 г кремнийсодержащего сырья с NaOH и SAS на фазовый состав кристаллических продуктов
| Шифр образцов | Ингредиенты смеси для щелочного плавления, г | Гидротермальная обработка | Молярное | Обнаруженные фазы, % | |||||||||
Цеолиты | Примеси | ||||||||||||
NaOH | SAS | H2O, г | Соотношение Ж : Т | Цеолит, | SiO2/Al2O3 | Na2O/ SiO2 | Н2О/ Na2O | NaA | NaX | NaP | Гидросодалит | SiO2 | |
1-NBS | 75,82 | 131,3 | 2175 | 14,7 : 1 | NaA | 1,5 | 1,5 | 130 | 13 | – | – | 43 | 11 |
2-NBS | 49,8 | 89,9 | 1448 | 7,83 : 1 | NaA | 2,0 | 1,0 | 83,0 | 56 | – | – | 12 | 14 |
3-NBS | 88,58 | 89,9 | 2199 | 10,2 : 1 | – | 2,0 | 1,5 | 84,0 | 8 | – | – | 75 | 8 |
4-NBS | 98,85 | 64,97 | 2180 | 10,6 : 1 | NaX | 2,5 | 1,5 | 83,3 | 4 | 74 | – | 10 | 6 |
5-NBS | 33,95 | 40,79 | 2513 | 17,7 : 1 | NaX | 3,3 | 0,6 | 240 | 4 | 63 | 6 | – | 9 |
6-NBS | 1,24 | – | 240 | 2,66 : 1 | NaA | 7,17 | 0,016 | 860 | 4 | – | – | 7 | 88 |
7-NBS | 55,05 | 100,8 | 1609 | 8,36 : 1 | NaA | 2,0 | 1,0 | 83,0 | 69 | – | – | 8 | – |
8-NBS | 54,57 | 73,1 | 1609 | 8,87 : 1 | NaX | 2,5 | 1,0 | 83,0 | 2 | 79 | – | 3 | – |
9-NBS | 49,8 | 89,9 | 1448 | 7,83 : 1 | NaA | 2,0 | 1,0 | 83,0 | 36 | – | – | 55 | – |
10-NBS | 75,82 | 131,3 | 2175 | 9,40 : 1 | – | 1,5 | 1,5 | 130 | – | – | – | 82 | – |
11-NBS | 98,85 | 64,97 | 2180 | 10,6 : 1 | – | 2,5 | 1,5 | 83,3 | – | – | – | 76 | 10 |
1-VKS | 52,65 | 67,13 | 1370 | 8,64 : 1 | NaA | 2,0 | 1,0 | 83,0 | 64 | – | – | 8 | – |
2-VKS | 89,3 | 67,13 | 2057 | 11,0 : 1 | NaA | 2,0 | 1,5 | 83,1 | 8 | – | – | 75 | – |
3-VKS | 59,92 | 43,53 | 1370 | 9,2 : 1 | NaX | 2,5 | 1,0 | 83,0 | 6 | 78 | – | 4 | – |
4-VKS | 37,62 | 20,67 | 824 | 7,0 : 1 | – | 3,3 | 0,6 | 83,2 | 10 | 24 | 38 | - | – |
5-VKS | 59,92 | 43,53 | 1370 | 9,17 : 1 | NaX | 2,5 | 1,0 | 83,0 | – | 75 | – | 25 | – |
6-VKS | 60,05 | 12,62 | 1194 | 8,64 : 1 | NaA | 2,0 | 1,0 | 83,0 | 83 | – | – | 3 | – |
7-VKS | 49,48 | 46,91 | 1194 | 7,87 : 1 | – | 1,5 | 1,0 | 83,0 | 25 | – | – | 64 | – |
8-VKS | 89,3 | 67,13 | 1370 | 8,64 : 1 | – | 2,0 | 1,0 | 83,0 | 6 | – | – | 90 | – |
Обсуждение результатов
Оптимальные условия термохимического разложения исходных источников кремния выбраны сопоставлением дифрактограмм щелочных сплавов, полученных при температурах 800, 810 и 830 ºС и предназначенных для синтеза образцов 1-NBS, 4-NBS, 2-VKS и 6-VKS, с результатами анализа твердых остатков от выщелачивания водой. Было показано, что почти полное преобразование монтмориллонита, каолинита и полиморфов SiO2 в алюмосиликаты натрия может быть достигнуто прокаливанием щелочных смесей при температуре не менее 810 ºС в течение 3 ч. На дифрактограммах щелочного сплава для образцов 1-NBS, 10-NBS и 7-VKS с дефицитом кремния (SiO2/Al2O3 = 1,5) наблюдались узкие рефлексы от нефелина – NaAlSiО4 с d = 0,4192; 0,3834; 0,3262; 0,3011; 0,2884 нм и очень широкие рефлексы с d = 0,53; 0,432; 0,282; 2,55; 2,30 нм от 2NaAlO2∙3Н2О. При соотношении SiO2/Al2O3 ≥ 2 и Na2O/SiO2 = 1 в дифрактограммах наблюдалось усиление фона в области углов 2θ = 5–35º от аморфных алюмосиликатов и SiO2, а взамен нефелина формировались кристаллы высокотемпературного алюмосиликата – Na4Al2Si2О9 (d = 0,4213; 0,2584; 0,1822 и 0,1487 нм). Проявлялись также следы высокотемпературной формы NaAlSiО4 (d = 0,423 и 0,2592 нм), слабые рефлексы от α-кристобалита (d = 0,4013; 0,3132; 0,2852;0,2481; 0,193; 0,187 нм), не прореагировавшего с NaOH или Na2CO3, и гидрослюды, не содержащей конституционной воды (d = 0,436; 0,302; 0,260; 0,225; 0,202 нм). На дифрактограмме сплава 4-NBS с некоторым профицитом соединений натрия, помимо кристаллической фазы Na4Al2Si2О9, были заметны ещё и рефлексы с d = 0,5302; 0,3563; 0,3041; 0,2574; 0,2403; 0,1885 и 0,1754 нм от Na2SiО3. В щелочных сплавах, как правило, преобладала фаза Na4Al2Si2О9, интенсивность рефлексов которой изменялась в ряду: 8-VKS ≈ 6-VKS < 1-VKS < 7-NBS < 2-NBS. В дифрактограммах остальных щелочных сплавов также присутствовали обе формы растворимых натрий-алюмосиликатов.
Сокращение времени помола или длительности термообработки щелочных сплавов сопровождалось появлением в дифрактограммах рефлексов при 2θº = 20,8º; 26,14º; 36,6º; 50,21º; 59,82º от кварца и около 2θº = 55,2º от γ-Al2O3. В отдельных экспериментах показано, что сплавление бентонита или каолина только с гидроксидом натрия при температуре 810оС было менее эффективно, чем комбинирование NaOH с суспензией алюмината натрия при соотношении щелочных компонентов NaOH : Na2CO3 = 5 : 1 и эквивалентном количестве Na2О. Продукты щелочного сплавления при температуре выше 800 ºС: аморфные силикаты, слабо окристаллизованные алюминаты натрия и кристаллические NaAlSiО4, Na4Al2Si2О9 и Na2SiО3 – хорошо растворялись в воде и находились в термодинамически нестабильном состоянии из-за большого количества разломов и свободных концов связей в местах их разрыва [23]. При оптимальной температуре 80ºС, рН = 12–13 и выдержке в автоклаве 4 ч растворенные продукты щелочного сплавления в зависимости от элементного состава кристаллизовались преимущественно в цеолиты типа NaХ (SiO2/Al2O3≈2,5), NaА (SiO2/Al2O3 ≈ 2,0) или NaР (SiO2/Al2O3≈3,33) (см. табл. 1). К цеолиту NaA отнесены характеристические дифракционные пики с d = 1,230; 0,870; 0,710; 0,550; 0,37; 0,328; 0,298 и 0,262 нм, а к цеолиту NaX пики с d = 1,447; 0,885; 0,754; 0,573; 0,380 и 0,288 нм [24]. Если процесс щелочного сплавления осуществляли при температуре 800 ºС, то аморфный SiO2, его кристаллические полиморфы и непрореагировавшие слюдистые минералы сильно засоряли конечный продукт (см. рис. 1, дифрактограмма 3). При сплавлении при 810ºС той же самой массы при 810ºС, что и на дифрактограмме 4-NBS, площадь пика от SiO2 (2θº = 26,6º) была в 18 раз меньше площади пика от фазы цеолита NaХ (2θº = 6,02º) [25].
Варьированием времени гидротермальной обработки фильтрата растворенных щелочных сплавов для образцов 2-NBS, 4-NBS, 1-VKS, 4-VKS и 5-VKS было установлено, что введение затравочных кристаллов NaA или NaХ сокращало время кристаллизации с 7 до 3–4 ч при суммарном выходе цеолитных фаз 56–78 %. Сокращение времени гидротермальной обработки до 1–2 ч резко уменьшало выход целевых продуктов, а на дифрактограммах интенсивность базовых рефлексов от цеолитных фаз при 2θº = 6,1–7,18º составляла 8–15 % от пика кварца при 2θº = 26,6º. Кристаллизация раствора щелочного сплава при 810 ºС более 4 ч на 7–8 % увеличивала выход цеолитов NaА и/или NaХ, но приводила к росту содержания посторонних фаз типа гидроксисодалита – пики с d = 0,633; 0,365; 0,258; 0,239 и 0,211 нм [24]. Увеличение времени кристаллизации при синтезе образца 6-VKS с 3,5 ч (см. табл. 1, рис. 3) до 5 ч сопровождалось повышением выхода цеолита NaA с 83 до 84 %, а гидроксисодалита с 3 до 11 %, что cовпадало с выводами исследований [14, 26]. Повышенное содержание кремния (SiO2/Al2O3 = 2,5–3,3) и затравка кристаллов NaX при гидротермальной обработке растворов щелочных сплавов бентонита с суспензией алюмината натрия приводили к преимущественному формированию фазы цеолита NaX с d = 0,1447; 0,885; 0,7,54; 0,573; 0,481; 0,442; 0,394; 0,381 нм (см. табл. 1).
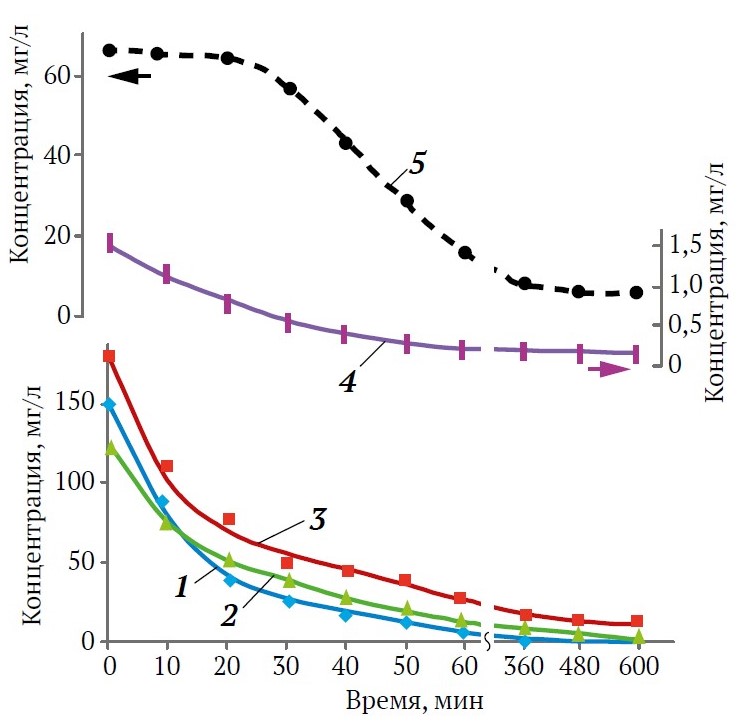
Рис. 3. Влияние времени контакта цеолитов с водой, содержащей ионы тяжелых металлов, на изменение концентрации растворов в системах: 1 – Сu2+/ 6-VKS, 2 – Fe2+/8-NBS, 3 – Zn2+/4-VKS, 4 – Pb2+/10-NBS, 5 – Сu2+/4-VKS
Катионы Na+ играли важную роль в цеолитизации, стабилизируя основные звенья цеолитовых каркасов в гидротермальных условиях [27]. От количества соединений натрия при сплавлении зависела не только степень разрушения исходных кристаллических веществ во время сплавления с образованием водорастворимых веществ, но и щелочность получаемого раствора для кристаллизации. Слабощелочная среда (рН = 8–8,5) во время синтеза образца 6-NBS при соотношении Na2О/SiO2 – 0,016 без добавки суспензии алюмината натрия привела к формированию аморфного кремнезема при минимуме кристаллических фаз. рН среды ≥ 14 во время гидротермальной стадии синтеза 1-NBS, 3-NBS, 10-NBS, 11-NBS, 2-VKS и 7-VKS обусловило явное преобладание фазы гидроксисодалита. Из табл. 1 следовало, что без затравочных кристаллов NaА или NaХ во время гидротермальной обработки растворов щелочного сплава с соотношением SiO2/Al2O3 в пределах 1,5–2,5 образовывалось от 64 до 90 % гидроксисодалита. На дифрактограммах к фазе гидроксисодалита были отнесены рефлексы с d = 0,6293; 0,3649; 0,2814; 0,2573; 0,209; 0,1812; 0,17398; 0,1572; 0,15263; 0,1483 и 0,14425 нм. Согласно литературным источникам гидроксисодалит представляет собой гидрофильный цеолит с формулой переменного состава типа Na6Al6Si6O24.8H2O [22], Na8[AlSiO4]6(OH)2.2H2O и других [16, 28]. Как было отмечено в обзорах [23, 26], скелет цеолита NaA - Na12Si12Al12O48.27H2O, образующийся в результате гидротермальной кристаллизации из растворов нефелина с расчетным соотношением SiO2/Al2O3 = 2, подвержен растрескиванию при высокой щелочности, что и обуславливало формирование гидросодалита. Известно, что кристаллы гидроксисодалита имеют кубическую форму с упорядоченным алюмосиликатным каркасом, в котором содалитовые клетки заключают в себе поры небольшого размера [29], что может быть полезным при выделении ионов металлов из водных растворов [28]. В наших экспериментах без внесения затравочных кристаллов, но с микроволновой обработкой были получены адсорбенты 10-NBS и 8-VKS, состоящие преимущественно из гидроксисодалита. Введение затравочных кристаллов цеолита NaА в реакционную смесь, подвергнутую микроволновой обработке, явно уменьшало не только количество балластного кварца, но и препятствовало формированию кристаллов цеолита NaА, что несколько отличалось от выводов, сделанных в статье [27], посвященной преобразованию золы уноса в цеолиты типа А с помощью микроволновой обработки.
Исследование адсорбционных свойств
Многофазность синтезированных адсорбентов, включающих два типа метастабильных цеолитных структур А и Х, наряду со стабильными фазами гидроксисодалита и цеолита NaP обусловила специфику адсорбционных свойств. Образцы с преобладанием фазы гидросодалита или цеолита NaP отличались большей плотностью и малой удельной поверхностью – около 33–76 м2/г, по сравнению с метастабильными цеолитами NaА и NaХ с аналогичным соотношением SiO2/Al2O3, удельная поверхность которых достигала 300 м2/г. Большой объем полостей, характерный для гидроксисодалита, позволял адсорбентам типа 10-NBS, 11-NBS и 8-VKS поглощать из воды некоторое количество ионов металлов, но крайне медленно. Испытания в статических условиях (см. рис. 3) проводили из растворов с концентрацией рудничных вод, характерной для полиметаллических руд [2], в том числе Алмалыкского рудного поля, которое включает в себя медно-порфировые и медно-колчеданно-полиметаллические месторождения с преобладанием сульфидов [30]. Однако, мониторинг природных вод в зоне влияния предприятий горно-обогатительных комбинатов и цветной металлургии свидетельствует о явном превышении санитарных норм в сточных водах При концентрации менее 0,003М и рН около 5 (рис. 3, кривые 1–4) металлы присутствовали в растворах практически в виде двухвалентных катионов. Адсорбционная емкость за 10 ч эксперимента не превышала (г/100 г) 0,38 Сu2+ для 8-VKS и 0,27 Pb2+ в случае 10-NBS, тогда как за тот же период емкость 100 г цеолита 6-VKS со структурой типа А, содержащего около 3 % гидроксисодалита, достигала, г: 29,2 Сu2+; 28,4 Zn2+; 18,3 Fe2+ и 3,1 Pb2+. Вследствие повышения рН до 5,1 при контакте с 0,05 г цеолита в результате ионообмена Сu2+ → 2Na+ уменьшалась конкуренция между катионами металлов и избытком протонов, а также происходила иммобилизация труднорастворимых гидроксокомплексов на поверхности адсорбентов, поэтому эффективность адсорбции соединений меди достигала 97 %. При увеличении навески цеолита до 0,06 г степень удаления указанных металлов из разбавленных растворов была не менее 98,5 %, что согласуется с литературными источниками [18, 19] для цеолитов на основе летучей золы. Максимальная способность к поглощению соединений железа и цинка была зафиксирована для цеолита 8-NBS, где преобладающей фазой был цеолит NaХ, г/100 г: 20,8 Fe2+ и 28,7 Zn2+. Гибридный образец 4-VKS, включающий преимущественно структуру цеолита NaР, а также некоторое количество NaХ и NaА, лучше поглощал свинец, чем 10-NBS – 1,2 Pb 2+ (г/100 г), но существенно уступал образцам 6-VKS и 8-NBS. Повышенное содержание фаз гидроксисодалита и SiO2 (кристаллического или аморфного) ухудшало способность адсорбентов к извлечению катионов металлов. При адсорбции из 1М растворов (потенциальная жидкая руда), где преобладали уже молекулярные формы тяжелых металлов, удаление токсичных элементов происходило преимущественно по механизму осаждения с образованием осадка Сu(ОН)2 и лишь при увеличении рН до 6,5 из-за высокой дозы цеолита степень удаления достигала 80 %.
Испытания оптимальных образцов в динамическом режиме показали, что при пропускании модельных растворов через слой цеолитов 8-NBS и 6-VKS высотой 1,2 м эффективность очистки от катионов Сu2+, Zn2+ и Fe2+ была не менее 95 %, а Pb2+ около 82 %.
Концентрация катионов меди в результате адсорбции на цеолитах 8-NBS и 6-VKS снижалась, мг/л: от 150 до 1,2–0,5 Сu2+, от 180 до 8,9–7,5 Zn2+, от 125 до 0,8–0,4 Fe2+, от 1,5 до 0,3 до 0,27 Pb2+. Результаты по адсорбции на цеолитах, синтезированных из местного минерального сырья щелочным сплавлением с отходами суспензии Al2O3-NaAlО2, подтверждены в процессе очистки реальных подотвальных вод месторождения Кульчулак. При степени удаления из воды с концентрацией, мг/л: Сu – 138, Zn – 169, Fe – 83, Pb – 1,8 в присутствии соединений серы и серебра, рН 4,9 была не ниже 80 %. После превышения концентрации Сu2+, Zn2+ и Fe2+ на выходе из адсорбционной колонки около 10 мг/л была доказана принципиальная возможность регенерации цеолитов, насыщенных катионами тяжелых металлов, путем пропускания раствора Na2CO3. Цеолиты 8-NBS и 6-VKS могут найти применение при очистке технологических вод Алмалыкского горно-металлургического комбината.
Заключение
Предварительное щелочное сплавление необогащенных глинистых минералов с отходом суспензии алюмината натрия обеспечило эффективное генерирование активных частиц кремния и алюминия, позволило увеличить выход продуктов цеолитной структуры и резко, вплоть до отсутствия, снизить количество балластной примеси кварца и муллита. Тенденция к формированию гидроксисодалита усиливалась при чрезмерном увеличении щелочности и длительности гидротермальной стадии.
При параметрах процесса водоочистки, сопоставимых с промышленными адсорбционными технологиями, возможно снижение концентрации меди, цинка и железа до близкой к уровню ПДК в воде хозяйственно-питьевого назначения. Цеолиты, синтезированные из необогащенного минерального сырья с высоким содержанием кварца, могут быть использованы в очистке технологической воды для снижения потребления воды горно-металлургическими предприятиями из внешних источников.
Список литературы
1. Растанина Н. К., Колобанов К. А. Воздействие техногенного пылевого загрязнения на экосферу и здоровье человека закрытого горного предприятия Приамурья. Горные науки и технологии. 2021;6(1):16–22. https://doi.org/10.17073/2500-0632-2021-1-16-22
2. Зверева В. П., Фролов К. Р., Лысенко А. И. Формирование рудничных вод в Дальневосточном регионе России и их влияние на экосферу и здоровье населения. Горные науки и технологии. 2022;7(3):203–215. https://doi.org/10.17073/2500-0632-2022-3-203-215
3. Шадрунова И. В., Орехова Н. Н. Технологические и эколого-экономические аспекты ресурсосберегающей переработки техногенного гидроминерального сырья горных предприятий цветной металлургии. Горный информационно-аналитический бюллетень. 2015;(S1):177–191.
4. Катаева С. Е., Шуляк Э. В., Брыль В. И., Чабан Н. Г. К вопросу о содержании тяжелых металлов в водной среде города Славутича. М.; 2000. С. 751–752.
5. Файзиева М. Ф. К вопросу санитарной охраны водоёмов в условиях Узбекистана. Вестник науки и образования. 2016;(4):70–72.
6. Collins F., Rozhkovskayaa A., Outramb J. G., Millarb G. J. A critical review of waste resources, synthesis, and applications for Zeolite LTA. Microporous and Mesoporous Materials. 2020;291:109667. https://doi.org/10.1016/j.micromeso.2019.109667
7. Tasić Ž. Z., Bogdanović G. D., Antonijević M. M. Application of natural zeolite in wastewater treatment – A review. Journal of Mining and Metallurgy. 2019;55A(1):67–79 https://doi.org/10.5937/JMMA1901067T
8. Белова Т. П., Ратчина Т. И., Гавриленко Ю. С. Адсорбция меди, никеля и кобальта натуральным цеолитом из водных растворов. Горный информационно-аналитический бюллетень. 2014;12:76–80.
9. Milicevic S., Povrenovic D., Milosevic V., Martinovic S. Predicting the copper adsorption capacity on different zeolites. Journal of Mining and Metallurgy. 2017;53A(1):57–63.
10. Srilai S., Tanwongwal W., Onpecth K. et al. Synthesis of Zeolite X from bentonite via hydrothermal method. Materials Science Forum. 2020;990:144–148. https://doi.org/10.4028/www.scientific.net/msf.990.144
11. Ma H., Yao Q., Fu Y. et al. Synthesis of zeolite of type A from bentonite by alkali fusion activation using Na2CO3. Industrial & Engineering Chemistry Research. 2009;49(2):454–458 https://doi.org/10.1021/ie901205y
12. Burоnоv F., Fayzullayev N. Synthesis and aррlicatiоn of high silicоn zeоlites frоm natural sources. In: AIP Conference Proceedings. The 1st International Conference on Problems and Perspectives of Modern Science: ICPPMS-2021. 10–11 June 2021, Tashkent, Uzbekistan. 2022;2432:050004. https://doi.org/10.1063/5.0089557
13. Jin Y., Li L., Liu Z. et al. Synthesis and characterization of low cost zeolite NaA from coalgangue by hydrothermal method. Advanced Powder Technology. 2021;32:791–801 https://doi.org/10.1016/j.apt.2021.01.024
14. Kong D., Jiang R. Preparation of NaA Zeolite from High Iron and Quartz Contents Coal Gangue by Acid Leaching-Alkali Melting Activation and Hydrothermal Synthesis. Crystals. 2021;11(10):1198. https://doi.org/10.3390/cryst11101198
15. Ma H., Zhu H., Wu C. et al. Study on compressive strength and durability of alkali-activated coal gangue-slag concrete and its mechanism. Powder Technology. 2020;368:112–124. https://doi.org/10.1016/j.powtec.2020.04.054
16. Kuroki S., Hashishin T., Morikawa T. et al. Selective synthesis of zeolites A and X from two industrial wastes: Crushed stone powder and aluminum ash. Journal of Environmental Management. 2019;231:749–756. https://doi.org/10.1016/j.jenvman.2018.10.082
17. Koukouzas N., Vasilatos C., Itskosa G. et al. Removal of heavy metals from wastewater using CFB-coal fly ash zeolitic materials. Journal of Hazardous Materials. 2010;173(1–3):581–588 https://doi.org/10.1016/j.jhazmat.2009.08.126
18. Hamadi A., Nabih K. Synthesis of zeolites materials using fly ash and oil shale ash and their applications in removing heavy metals from aqueous solutions. Hindawi Journal of Chemistry. 2018;2018(1):6207910. https://doi.org/10.1155/2018/6207910
19. Somerset V., Petrik L., Iwuoha E. Alkaline hydrothermal conversion of fly ash filtrates into zeolites 2: Utilization in wastewater treatment. Journal of Environmental Science and Health, Part A. 2005;40(8):1627–1636. https://doi.org/10.1081/ESE-200060675
20. Bessa R., Costa L., Oliveira C. et al. Kaolin-based magnetic zeolites A and P as water softeners. Microporous and Mesoporous Materials. 2017;245:64–72. http://dx.doi.org/10.1016/j.micromeso.2017.03.004
21. Tayraukham P., Jantarit N., Osakoo N., Wittayakun J. Synthesis of pure phase NaP2 zeolite from the gel of NaY by conventional and microwave-assisted hydrothermal methods. Crystals. 2020;10(10):951. http://dx.doi.org/10.3390/cryst10100951
22. Wajima T., Munakata K., Ikegami Y. Conversion of waste sandstone cake into crystalline zeolite X using alkali fusion. Materials Transactions. 2010;51(5):849–854. https://doi.org/10.2320/matertrans.MH200905
23. Lee Y.-R., Soe J. T., Zhang S. et al. Synthesis of nanoporous materials via recycling coal fly ash and other solid wastes: A mini review. Chemical Engineering Journal. 2017:317;821–843. http://dx.doi.org/10.1016/j.cej.2017.02.124
24. Kunecki P., Panek R, Wdowin M. et al. Influence of the fly ash fraction after grinding process on the hydrothermal synthesis efficiency of Na-A, Na-P1, Na-X and sodalite zeolite types. International Journal of Coal Science & Technology. 2021;8(2):291–311 https://doi.org/10.1007/s40789-020-00332-1
25. Hu T., Gao W., Liu X. et al. Synthesis of zeolites Na-A and Na-X from tablet compressed and calcinated coal fly ash. Royal Society Open Science. 2017;4:170921. http://dx.doi.org/10.1098/rsos.170921
26. Yang L., Qian X., Yuan P. et al. Green synthesis of zeolite 4A using fly ash fused with synergism of NaOH and Na2CO3. Journal of Cleaner Production. 2019;212:250–260. https://doi.org/10.1016/j.jclepro.2018.11.259
27. Mallapur V. P., Oubagaranadin J. U. K. A brief review on the synthesis of zeolites from hazardous wastes. Transactions of the Indian Ceramic Society. 2017;76(1):1–13. https://doi.org/10.1080/0371750X.2016.1231086
28. Golbad S., Khoshnoud P., Abu-Zahra N. Hydrothermal synthesis of hydroxy sodalite from fly ash for the removal of lead ions from water. International Journal of Environmental Science and Technology. 2017;14(1):135–42. https://doi.org/10.1007/s13762-016-1133-x
29. Shabani J. M., Omotola B., Oyekola O., Petrik L. Synthesis of hydroxy sodalite from coal fly ash for biodiesel production from waste-derived maggot oil. Catalysts. 2019;9(12):1052. https://doi.org/10.3390/catal9121052
30. Василевский Б. Б., Ежков Ю. Б., Рахимов Р. Р. и др. Проблемы крупнообъемных месторождений золота и меди Узбекистана. Ташкент; 2012. 116 с.
Об авторах
Е. И. МирзаеваУзбекистан
Елена Иннокентьевна Мирзаева – PhD (техн.), доцент кафедры металлургии
г. Алмалык
Н. Ф. Исаева
Узбекистан
Нурхон Фархатовна Исаева – PhD (техн.), докторант
г. Ташкент
Э. Я. Ялгашев
Узбекистан
Элмурод Яхшибой угли Ялгашев – докторант, старший научный сотрудник
г. Ташкент
Д. П. Турдиева
Узбекистан
Дилноза Пердеш қизи Турдиева – докторант, младший научный сотрудник
г. Ташкент
Р. М. Боймонов
Узбекистан
Руфатжон Машариф угли Боймонов – старший преподаватель кафедры машин и оборудования нефтегазовой промышленности и систем трубопроводного транспорта
г. Ташкент
Рецензия
Для цитирования:
Мирзаева Е.И., Исаева Н.Ф., Ялгашев Э.Я., Турдиева Д.П., Боймонов Р.М. Получение адсорбентов для извлечения тяжелых металлов из сточных вод горнорудной промышленности. Горные науки и технологии. 2025;10(1):45-55. https://doi.org/10.17073/2500-0632-2024-02-224
For citation:
Mirzaeva E.N., Isaeva N.F., Yalgashev E.Ya., Turdiyeva D.P., Boymonov R.M. Preparation of adsorbents for the extraction of heavy metals from mining wastewater. Mining Science and Technology (Russia). 2025;10(1):45-55. https://doi.org/10.17073/2500-0632-2024-02-224
JATS XML




































